MICOPLASMOSIS
Ocasionada por las bacterias mycoplasma hominis y ureoplasma urealyticum.
MICOPLASMOSIS PORCINAS
Las micoplasmosis porcinas comprenden una serie de procesos patológicos producidos por
microorganismos pertenecientes al género Mycoplasma. La neumonía micoplásmica es una enfermedad causada
por Mycoplasma hyopneumoniae que se estima estar presente en el 90 % de las granjas y en un 80 % de los
cerdos a nivel mundial haciendo de ella una de las enfermedades más prevalentes y económicamente
importantes en la producción porcina actual. Por su parte, los otros micoplasmas, ya de menor importancia, que
pueden afectar al cerdo son Mycoplasma hyorhinis responsable de cuadros de poliserositis y artritis en los
lechones y Mycoplasma hyosinoviae asociado a procesos de artritis en cerdos de cebo.
La neumonía enzoótica porcina,está producida por Mycoplasma hyopneumoniae, se habla también de Mycoplasmosis porcina y su importancia como patógeno, estriba sobretodo en la disminución de rendimientos que provoca (retrasos en el crecimiento y aumento del índice de conversión) y en favorecer la participación de los llamados agentes infecciosos secundarios.
El punto central sobre el que se orientan la mayoría de los estudios de la patogenia de está enfermedad es la interacción entre el micoplasma y la membrana citoplasmática de las células epiteliales de las vías respiratorias (Fig. 1).
M. hyopneumoniae es un microorganismo extracelular cuya presencia sobre la mucosa del aparato respiratorio disminuye en el curso de la enfermedad, llegando prácticamente a desaparecer en las fases más avanzadas de la misma, pudiendo persistir o potenciarse su permanencia cuando esta asociado a una nueva bacteria secundaria recientemente descrita en porcinos, denominada (CAR-bacillus) (Cilia Asociated Respiratory Bacilllus).
El período de incubación de la NEP, así como el período activo de enfermedad (aquel en el que se manifiestan síntomas y signos clínicos) probablemente dependan de la exposición de los animales susceptibles y de la virulencia de la cepa comprometida. Estos cerdos desarrollan lesiones pulmonares evidentes a partir de los 7 a los 10 días después de la infección (Fig. 2).
La infección se origina normalmente cuando los lechones que poseen anticuerpos maternales son trasladados a las naves de engorde después del destete. Así, los lechones pasan inicialmente protegidos a estas naves, pero al perderlos quedan expuestos a los aerosoles contaminados con Mh procedentes de los animales de mayor edad que permanecen en la nave
Una vez que estos cerdos susceptibles se infectan con Mh, éste se adhiere al epitelio ciliado de las vías respiratorias (Fig. 4). Con el tiempo, el agente causal se multiplica y avanza por el árbol bronquial. La adhesión de M. hyopneumoniae al epitelio respiratorio es un fenómeno que, resulta de gran importancia en la patogenia de la enfermedad, ya que es el grado de adherencia el que determina la patogenicidad de las diferentes cepas de M. hyopneumoniae
La adhesión del micoplasma a los cilios de las células epiteliales provoca, por un lado, su pérdida, (Fig. 5) comprometiendo el mecanismo defensa y por otra, un efecto citopático sobre la célula lo que se atribuye, no sólo a la capacidad de adhesión, sino también a una competencia metabólica entre el agente patógeno y la célula epitelial. La muerte celular consiguiente y su descamación provocan, como respuesta, una hiperplasia epitelial que intenta reparar la pérdida de las células (Fig. 6) (Kobisch y Friis, 1996).
En la adhesión del micoplasma a las células epiteliales ciliadas juegan un papel importante el material capsular y las fibrillas del micoplasma. La importancia de esta interacción micoplasma-célula es tal que una de las medidas preventivas que se pretenden alcanzar en el futuro es impedir, de algún modo, esa unión entre la membrana celular y la del micoplasma.
El tipo de consolidación pulmonar observado en la neumonía micoplásmica porcina refleja una distribución broncogénica que compromete la limpieza mucociliar (Fig. 7).
En cuanto a la transmisión, la principal fuente de infección en una granja es la introducción de cerdos con infección aguda o portadores. Se cree que la Neumonía Enzoótica se mantiene en las granjas infectadas, por tres mecanismos:
- Por transmisión de M. hyopneumoniae de cerdas infectadas a sus lechones.
- Por transmisión de cerdos infectados a otros cerdos en la fase de lactación y transiciones.
- Y por transmisión de cerdos de las fases de crecimiento y acabado a cerdos más jóvenes que entran en estas instalacione.
Cuando los lechones se infectan a una edad muy temprana, los propios animales afectados se convierten en excretores de Micoplasma. Una vez se infecta la granja, M. hyopneumoniae se extenderá lentamente a toda la población susceptible. Los lechones recién nacidos son infectados por hembras cuya función es la de animales portadores (transmisión vertical). Es más, son mayoría las hembras primíparas las que excretan M. hyopneumoniae, infectando así directamente a su descendencia. La excreción de micoplasma por las hembras primíparas es atribuible a la baja inmunidad contra el micoplasma en estas cerdas.
Es menos probable que transmitan la enfermedad a su descendencia las cerdas más mayores que las cerdas más jóvenes. Los cerdos también pueden ser infectados por otros cerdos (transmisión horizontal); el Micoplasma se trasmite de unos animales infectados a otros por aerosol (transmisión por vía aérea) o por contacto directo con las secreciones respiratorias de los animales infectados.
La propagación de M. hyopneumoniae de una granja a otra es más probable cuando hay poca distancia entre granjas, cuando la zona es de alta densidad porcina es densa y cuando hay distancias cortas de la explotación a rutas de alto tráfico de porcino.
VACUNA:
Bayovac Neumogard, es la única vacuna subunitaria a nivel mundial para proteger contra micoplasmosis porcina, la cual, por su exclusivo método de inactivación a través de un sofisticado proceso de sonificación, permite aislar las fracciones antigénicas involucradas en la generación de protección contra esta enfermedad.
ASPECTOS EPIDEMIOLÓGICOS
La epidemiología de la infección por M. hyopneumoniae ha dado un cambio importante a lo largo de los años; inicialmente era considerada como una enfermedad de animales jóvenes, que en muchos casos era derivada de un contacto más prolongado con la cerda y que causaba su mayor daño en los destetes (25). Sin embargo, desde hace algunos lustros se comprueba que los problemas se han agravado y fundamentalmente se presentan en la etapa de finalización. Estos hechos se fundamentan en los cambios que han tenido los sistemas de manejo y la interacción con otros agentes fundamentalmente víricos.
La neumonía enzoótica es una enfermedad de distribución mundial, presente en casi todos los países con una industria porcina importante. Las inspecciones realizadas en estas poblaciones muestran que entre el 60-99% de las granjas son positivas a Mycoplasma hyopneumoniae, con presencia de lesiones de neumonía enzoótica hasta en un 70-95% de los cerdos sacrificados (61). Sólo en Dinamarca, un 25% de los cerdos sacrificados están libres del mismo como consecuencia de la aplicación de las medidas que impone el sistema SPF (11).
Los únicos reservorios y fuentes de infección son los propios cerdos y sus secreciones; fundamentalmente las reproductoras mediante contagio vertical hacia sus lechones, y los propios lechones infectados como fuente de infección hacia sus compañeros. La enfermedad raramente se presenta antes de las seis semanas de edad, sugiriendo que la transmisión de la cerda a los lechones durante la lactancia se produce de forma poco eficiente, bien debido a la baja eliminación del agente por la cerda y/o a la presencia de inmunidad calostral. Estos individuos, inicialmente protegidos, podrían infectarse posteriormente por contagio horizontal con lechones de su paridera o de otras camadas, apareciendo tras un periodo de incubación de 10-15 días, brotes neumónicos a mediados o final de cebo (61).
La infección se transmite vía inhalatoria por contacto directo (roce de jetas) de los animales susceptibles con las secreciones respiratorias de los cerdos portadores infectados, o bien de forma indirecta, en distancias cortas a partir del aire, habiéndose identificando Mhp mediante PCR en naves con cerdos infectados; en estos casos se ha relacionado el tiempo de incubación de la enfermedad con la dosis infectiva presente en las naves pudiendo, por ello, oscilar entre 11 días y 4 a 6 semanas (68).
La transmisión aérea es un mecanismo para la reinfección de explotaciones libres. Se estima que granjas infectadas a menos de 3 Km, en condiciones climáticas adecuadas, pueden reintroducir Mhp en granjas libres. La teoría de la transmisión aérea de Mhp se apoya en su supervivencia en agua a temperaturas de 2 a 7º C durante por lo menos un mes (38, 69).
Las multíparas son capaces de conferir un mayor nivel de anticuerpos maternales a los lechones, siendo el estado de portador y eliminador inversamente proporcional a la edad de los reproductores en granjas con la infección de Mhp endémica (61). No se sabe durante cuánto tiempo pueden ser portadores de Mhp los verracos y las cerdas. En un estudio más reciente, los hisopos nasales analizados mediante PCR fueron positivos en las cerdas hasta su séptimo parto. Sin embargo, no se encontró correlación entre la colonización de las cerdas y los niveles de anticuerpos calostrales en sus lechones. Los resultados de este estudio sugieren que no sólo las cerdas jóvenes, sino también las adultas (de tres a siete partos) tienen el potencial de transmitir Mhp a sus lechones (17).
La persistencia de los anticuerpos maternales en los lechones resulta variable en función de los niveles de infección, edad de las reproductoras y la previa vacunación de las madres. Mediante ELISA, se ha podido detectar anticuerpos maternos en lechones de hasta siete semanas de edad. La vacunación de las cerdas tres veces antes del parto puede prolongar hasta las nueve semanas de edad (5, 80).
Inoculaciones experimentales por vía intratraqueal a grupos de cerdos con seis cepas de Mhp diferentes, demostraron diferencias en el cuadro clínico y en la respuesta serológica indicando que pueden existir distintos grados de virulencia entre las cepas de Mhp aunque las investigaciones no concluyen a qué factores estructurales del microorganismo pueden estar asociados (85). Los micoplasmas, se caracterizan por poseer un magnífico sistema genético que es capaz de alterar rápidamente los antígenos y estructura de la superficie de su membrana; esta versatilidad constituye una estrategia de supervivencia en los organismos que parasitan (86). Cepas de M. hyopneumoniae aisladas en Gran Canaria presentaban variabilidad proteica y en mayor medida variabilidad antigénica. En general los perfiles proteicos de las diferentes cepas mediante la técnica de SDS-PAGE demostraron ser bastante homogéneos, mientras que los perfiles antigénicos estudiados por la técnica de immunoblot fueron bastante heterogéneos (6). La variabilidad de esta especie, puede ser una de las causas de la falta de eficacia en las medidas de inmunoprofilaxis contra esta enfermedad, confiriendo diversidad en la virulencia a cada una de las cepas de M. hyopneumoniae.
La epidemiología de la infección por M. hyopneumoniae ha dado un cambio importante a lo largo de los años; inicialmente era considerada como una enfermedad de animales jóvenes, que en muchos casos era derivada de un contacto más prolongado con la cerda y que causaba su mayor daño en los destetes (25). Sin embargo, desde hace algunos lustros se comprueba que los problemas se han agravado y fundamentalmente se presentan en la etapa de finalización. Estos hechos se fundamentan en los cambios que han tenido los sistemas de manejo y la interacción con otros agentes fundamentalmente víricos.
La neumonía enzoótica es una enfermedad de distribución mundial, presente en casi todos los países con una industria porcina importante. Las inspecciones realizadas en estas poblaciones muestran que entre el 60-99% de las granjas son positivas a Mycoplasma hyopneumoniae, con presencia de lesiones de neumonía enzoótica hasta en un 70-95% de los cerdos sacrificados (61). Sólo en Dinamarca, un 25% de los cerdos sacrificados están libres del mismo como consecuencia de la aplicación de las medidas que impone el sistema SPF (11).
Los únicos reservorios y fuentes de infección son los propios cerdos y sus secreciones; fundamentalmente las reproductoras mediante contagio vertical hacia sus lechones, y los propios lechones infectados como fuente de infección hacia sus compañeros. La enfermedad raramente se presenta antes de las seis semanas de edad, sugiriendo que la transmisión de la cerda a los lechones durante la lactancia se produce de forma poco eficiente, bien debido a la baja eliminación del agente por la cerda y/o a la presencia de inmunidad calostral. Estos individuos, inicialmente protegidos, podrían infectarse posteriormente por contagio horizontal con lechones de su paridera o de otras camadas, apareciendo tras un periodo de incubación de 10-15 días, brotes neumónicos a mediados o final de cebo (61).
La infección se transmite vía inhalatoria por contacto directo (roce de jetas) de los animales susceptibles con las secreciones respiratorias de los cerdos portadores infectados, o bien de forma indirecta, en distancias cortas a partir del aire, habiéndose identificando Mhp mediante PCR en naves con cerdos infectados; en estos casos se ha relacionado el tiempo de incubación de la enfermedad con la dosis infectiva presente en las naves pudiendo, por ello, oscilar entre 11 días y 4 a 6 semanas (68).
La transmisión aérea es un mecanismo para la reinfección de explotaciones libres. Se estima que granjas infectadas a menos de 3 Km, en condiciones climáticas adecuadas, pueden reintroducir Mhp en granjas libres. La teoría de la transmisión aérea de Mhp se apoya en su supervivencia en agua a temperaturas de 2 a 7º C durante por lo menos un mes (38, 69).
Las multíparas son capaces de conferir un mayor nivel de anticuerpos maternales a los lechones, siendo el estado de portador y eliminador inversamente proporcional a la edad de los reproductores en granjas con la infección de Mhp endémica (61). No se sabe durante cuánto tiempo pueden ser portadores de Mhp los verracos y las cerdas. En un estudio más reciente, los hisopos nasales analizados mediante PCR fueron positivos en las cerdas hasta su séptimo parto. Sin embargo, no se encontró correlación entre la colonización de las cerdas y los niveles de anticuerpos calostrales en sus lechones. Los resultados de este estudio sugieren que no sólo las cerdas jóvenes, sino también las adultas (de tres a siete partos) tienen el potencial de transmitir Mhp a sus lechones (17).
La persistencia de los anticuerpos maternales en los lechones resulta variable en función de los niveles de infección, edad de las reproductoras y la previa vacunación de las madres. Mediante ELISA, se ha podido detectar anticuerpos maternos en lechones de hasta siete semanas de edad. La vacunación de las cerdas tres veces antes del parto puede prolongar hasta las nueve semanas de edad (5, 80).
Inoculaciones experimentales por vía intratraqueal a grupos de cerdos con seis cepas de Mhp diferentes, demostraron diferencias en el cuadro clínico y en la respuesta serológica indicando que pueden existir distintos grados de virulencia entre las cepas de Mhp aunque las investigaciones no concluyen a qué factores estructurales del microorganismo pueden estar asociados (85). Los micoplasmas, se caracterizan por poseer un magnífico sistema genético que es capaz de alterar rápidamente los antígenos y estructura de la superficie de su membrana; esta versatilidad constituye una estrategia de supervivencia en los organismos que parasitan (86). Cepas de M. hyopneumoniae aisladas en Gran Canaria presentaban variabilidad proteica y en mayor medida variabilidad antigénica. En general los perfiles proteicos de las diferentes cepas mediante la técnica de SDS-PAGE demostraron ser bastante homogéneos, mientras que los perfiles antigénicos estudiados por la técnica de immunoblot fueron bastante heterogéneos (6). La variabilidad de esta especie, puede ser una de las causas de la falta de eficacia en las medidas de inmunoprofilaxis contra esta enfermedad, confiriendo diversidad en la virulencia a cada una de las cepas de M. hyopneumoniae.
MICOPLASMOSIS AVIARES
Descripción de la enfermedad:
Presentación:
La Micoplasmosis afecta en primer término a las gallinas y a los pavos. En casos aislados la padecen otras aves (patos, pavos reales, perdices y faisanes).
ETIOLOGÍA Y CONTAGIO:
Los agentes causales de las Micoplasmosis son microorganismos que por su tamaño se encuentran entre las bacterias y los virus. El agente patógeno de la E.R.C es el Mycoplasma gallisepticum. La infección de los planteles avícolas ocurre generalmente de dos formas : vertical y horizontal. La vía vertical o transovárica se produce debido a que los micoplasmas colonizan principalmente el epitelio de la tráquea, las membranas de los sacos aéreos y la mucosa interna del oviducto. El huevo se contamina después del desprendimiento de la yema del ovario en la fase migratoria por el oviducto. La transmisión horizontal ocurre directamente por contacto entre las aves, por aspiración del polvo contaminado, el agua de bebida, los utensilios contaminados y a través de portadores intermediarios como el hombre.(SASIPREEYAJAN, J. Avian Dis. 31.776-81,1987). En la difusión de las micoplasmosis participan igualmente las aves de consumo, porque los micoplasmas son resistentes a las temperaturas bajas. A -30° C sobreviven durante varios años (YODE y HOFSTAD, 1965). La Micoplasmosis es una enfermedad dependiente de varios factores. El desencadenamiento de la enfermedad no depende exclusivamente del agente etiológico, sino que la favorece la disminución de la capacidad de resistencia a consecuencia de estados de "stress", la superpoblación de los galpones, las corrientes de aire, el calor y el frío excesivos, los cambios de alojamiento, el transporte y otros factores análogos. La participación conjunta de otros gérmenes influye sobre el desencadenamiento y el curso de la Micoplasmosis. GROSS (1957) ha llamado la atención sobre la importancia de la E. coli a ese respecto y también la de las infecciones víricas adicionales ,como la Bronquitis Infecciosa o la enfermedad de Newcastle.
SINTOMATOLOGÍA:
El período de incubación de la Micoplasmosis de la gallina varía entre 10 y 30 días. Los pollitos presentan a menudo conjuntivitis y una escasa secreción serosa entre los párpados y en los orificios nasales al comienzo de la enfermedad. En los lotes enfermos se oyen ruidos respiratorios, como especie de chasquidos y otros que denuncian la presencia de mucosidad en las vías respiratorias altas. El consumo disminuye ostensiblemente, el plumaje está erizado, los animales abatidos y respiran con el pico abierto. Tras el adelgazamiento sobreviene finalmente la muerte. El curso ofrece un carácter insidioso en su conjunto y es lento en su desarrollo si se trata de animales jóvenes. Los lotes presentan gran desigualdad. Revisten una gravedad acusada las micoplasmosis en aves de engorde. Dan lugar a pesos muy reducidos, sobre todo en la terminación, aparte de que las bajas por muerte sean casi siempre más numerosas que en aves de postura. Los brotes de micoplasmosis en aves de postura van unidos a un
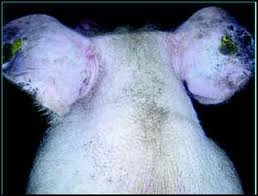
descenso lento de la producción, cifrado entre el 5 y el 20%. Raras veces disminuye más, como consecuencia de esta enfermedad. Si sucediera así, habría que pensar en la participación de otras infecciones, sobre todo de origen viral. El grave perjuicio económico de las micoplasmosis no consiste tanto en el nivel de descenso de la producción como en la persistencia de éste durante varias semanas. Es muy frecuente que la Micoplasmosis se transforme en un proceso marcadamente crónico en la gallina ponedora. La secreción nasal, al principio acuosa se hace más densa y se acumula en los senos infraorbitarios. Entre la región nasal y los ojos se forman tumefacciones que recuerdan los "ojos de búho" de la coriza aviar. Los animales adelgazan entonces intensamente y se producen frecuentes bajas por muerte.
Diagnóstico:
Las reacciones serológicas positivas no son suficientes para deducir la existencia de la Micoplasmosis en sentido clínico. La demostración del agente causal en los órganos infectados es posible mediante el cultivo en medios apropiados pero resulta laborioso y requiere tiempo. La necropsia de las aves enfermas revela lesiones inflamatorias en pulmón y sacos aéreos. Estas lesiones son, sobre todo, la consecuencia de infecciones secundarias y concomitantes por E.Coli en pericardio y cápsula hepática.
Tratamiento:
Para el tratamiento de las aves enfermas se han acreditado en particular el tartrato de tilosina, el aivlosín y la tiamulina.
Desinfección:
Los micoplasmas resisten a temperaturas de - 25°C y más bajas durante unos años. Pero su resistencia al calor es menor. A 5° pierden su capacidad infectante en tres semanas. Sin embargo soportan temperaturas de 12° a 18°C en un ambiente de humedad, durante 23 días. Los desinfectantes usuales son eficaces contra los Micoplasmas, la solución de formalina al 0,2% -0,5%, los mata en un minuto si no se hallan protegidos. Pero es necesario una solución al 2% si están envueltos en material que contenga albúmina. Ver Manual de Procedimientos de Desinfección
Profilaxis:
La gran importancia económica de la Micoplasmosis ha hecho que en los últimos años se estudiase detenidamente la manera de combatirla. MEDIDAS PARA CONTROLAR LOS EFECTIVOS EXENTOS DE MICOPLASMAS: El control permanente de las aves orienta sobre el resultado de los esfuerzos de saneamiento de las explotaciones de reproductores que tratan de erradicar la micoplasmosis o de conservar su estado de indemnidad. Para ello se toman muestras de sangre de un cierto número de animales, con el objeto de demostrar la presencia de aglutininas en el suero, poniendo éste en contacto con el antígeno correspondiente. Los animales que han sufrido la infección contienen anticuerpos contra los Micoplasmas en el suero durante toda su vida. Estos anticuerpos aglutinan los micoplasmas contenidos en el antígeno de prueba dando una reacción evidente. Pero la reacción de aglutinación debe considerarse únicamente como prueba colectiva. Las reacciones positivas indican que el efectivo es portador de micoplasmas y se halla por tanto infectado. El control serológico de la micoplasmosis se realiza en general mediante el examen de muestras al azar . Para descubrir los anticuerpos contra los micoplasmas se toman muestras de sangre del 1 al 10% de las
aves cada vez, en cuatro o cinco pruebas durante el período de explotación. Como en esta investigación serológica se presentan a menudo reacciones inespecíficas, son necesarias otras pruebas adicionales de laboratorio para asegurar el resultado. Pueden utilizarse , el suero de los pollitos de 1 día para efectuar la reacción de aglutinación, con el objeto de controlar los planteles de reproductores, puesto que las madres infectadas transmiten anticuerpos a los hijos a través del huevo. Hasta el presente, el control de las Micoplasmosis Aviares, solo es factible a través de la eliminación y sacrificio de los planteles infectados, reemplazándolos por planteles libres que deben ser tratados como tales desde el primer día de vida a partir del cual, el esfuerzo de saneamiento debe estar concentrado en la constancia de implementación de medidas de bioseguridad que apuntan a conservar el estado de indemnidad del lote.
Manifestaciones clínicas
Bajo condiciones naturales, el período de incubación de la infección por M. gallisepticum
puede variar de 3 a 38 semanas. En los lotes infectados a través del huevo los signos
clínicos pueden desarrollarse en algunos casos entre las 3 y 6 semanas de edad y en
otros, al inicio de la producción de huevos. En el caso de granjas con pollos provenientes
de huevos sumergidos en soluciones de antibióticos para el control de M. gallisepticum, los
signos clínicos pueden manifestarse después de la aparición de otras enfermedades o un
estrés (Stipkovits y Kempf, 1996).
Los signos clínicos más comunes en pollos y pavos son descargas nasales, ruidos
traquéales, tos, estornudos y exudados de uno o ambos senos infraorbitales mayormente
en pavos y conjuntivitis media. En algunos casos son observados signos como ataxia,
cojera y ensanchamiento del globo ocular. El apetito permanece cerca de lo normal tanto
tiempo como las aves puedan comer. Son observados también signos clínicos no específicos tales como una reducción del crecimiento y la producción de huevos y una
afectación de la eficacia de la conversión de alimentos (Stipkovits y Kempf, 1996).
La severidad de las manifestaciones clínicas de la infección producida por M. gallisepticum
varía ampliamente, estando fuertemente influenciada por infecciones secundarias, factores
ambientales como la ventilación, humedad, concentración de amonio y la temperatura. Es
conocido por ejemplo, que en las condiciones de bajas temperaturas de los meses de
invierno la enfermedad es más severa y de mayor duración (Kleven, 1998). Otros
aspectos a tener en cuenta son las diferencias encontradas entre cepas de esta especie
en cuanto a virulencia (Soeripto y col., 1989) y tropismo por los tejidos (Chin y col.,
1991). La morbilidad también varía en función de la edad y sexo de las aves. Los pollos
jóvenes son más severamente afectados y los machos generalmente expresan signos
clínicos más severos que las hembras (Stipkovits y Kempf, 1996).
Lesiones
Las lesiones provocadas por la infección por M. gallisepticum incluyen un exceso de mucus
en el tracto respiratorio, exudado catarral en la nariz, senos, tráquea, bronquios,
pulmones y sacos aéreos, edema de las paredes de los sacos aéreos y exudado caseoso
en los mismos y en el oviducto. En casos complicados pueden observarse pericarditis,
perihepatitis y algunas veces, exudados y edema del tejido periarticular, exceso de fluido
en las articulaciones, erosión de la superficie articular (artritis), inflamación de la bolsa y
la membrana sinovial y palidez en áreas del cerebro (Yoder, 1991).
Métodos de control de la infección por M. gallisepticum.
Las estrategias para reducir el impacto de las infecciones de M. gallisepticum en aves
comerciales incluyen programas de supervisión, control y erradicación. Mundialmente se
trabaja para que la mayoría de las empresas de las líneas genéticas de engorde y
ponedoras estén libres de micoplasmas, con el objetivo de lograr que las progenies que se
distribuyan comercialmente estén libres de estos gérmenes (Kleven, 1998a). El mejor
método para el control de M. gallisepticum en los lotes infectados es la despoblación
(Nepomuceno, 2000), pero este método no siempre resulta factible económicamente,
sobre todo cuando no pueden garantizarse medidas de bioseguridad que eviten la
infección de los lotes posteriormente. De ahí que como un método alternativo se utilice el
tratamiento con antibióticos (Jordan y col., 1998); este tratamiento es efectivo en la
reducción de los signos clínicos y las pérdidas en la producción pero hace muy poco en
cuanto a la eliminación de la infección, además, es un tratamiento extremadamente
costoso.
Para los casos en que no es posible controlar la infección, los programas de vacunación
son de gran utilidad para disminuir las pérdidas económicas en la producción de
ponedoras y pollos de engorde infectados (Braton y col., 1999).
2.4.1. Control de M. gallisepticum por vacunación
La vacunación tiene dentro de sus propósitos prevenir la infección del tracto respiratorio,
evitar la pérdida de huevos asociados a esta infección en ponedoras y reproductoras,
reducir los costos de medicación y la transmisión vertical de M. gallisepticum de la madre
a la progenie a través del huevo (Levinshon y Kleven, 2000; Patala, 2000). Para el caso
de vacunas vivas en crías de edades múltiples, otro de sus objetivos es facilitar la
erradicación de esta entidad reduciendo los reservorios de la infección y/o remplazando
las cepas endémicas por cepas vacunales vivas de menor patogenicidad fácilmente
transmisibles (Whithear, 1996).
Su empleo es ampliamente reportado en la literatura, a través del uso de vacunas de
cultivos inactivados de células completas (bacterinas) o vacunas de cultivos vivos. Aunque
se observa variabilidad antigénica entre cepas de M. gallisepticum esta no parece ser
suficiente para elaborar vacunas multivalentes (Whithear, 1996).
2.4.1.1. Vacunas vivas atenuadas.
Durante muchos años ha estado disponible comercialmente una vacuna viva elaborada
con la cepa F de M. gallisepticum, de amplio uso en los E.U.A., para la prevención de
pérdidas en la producción de huevos en granjas compuestas por parvadas de edades
múltiples (Kleven, 1998).
En los últimos años se han introducido dos cepas adicionales de M. gallisepticum, que se
utilizan como vacunas vivas, la cepa ts-11 (mutágeno sensible a la temperatura) (Soeripto
y col., 1989) y la cepa Intervet 6/85, ambas son cepas atenuadas artificialmente de baja
virulencia que están licenciadas en E.U.A. y probadas en Australia e Israel (Whithear,
1996).
La preparación vacunal de la primera, es formulada como cultivo fresco o congelado a –70
º C, o a partir de cultivos liofilizados para ser administrada en aerosol o por inoculación
conjuntival en dosis mayores e iguales de 10 7.7 UFC/mL. La concentración de microorganismos viables usados en el campo varía entre 105,7 y 107,7 UFC/mL a 109
UFC/mL (Colleie, 1996).
La cepa 6/85 es administrada en aerosol, en la dosis de 0.5 mL/ave con un título de 10 7 a
10 8 UFC/mL, resultando eficaz frente al desafío experimental por aerosol con la cepa R de
M. gallisepticum (10 8 UFC/mL), 4 semanas post-vacunación (Evans y col., 1992).
Felina
Micoplasma | Conjuntivitis . Afección del tracto respiratorio superior | Flujo ocular seroso, flujo nasal | Conjuntivitis |



No hay comentarios:
Publicar un comentario